ISO13485-2016国际标准
医疗器械-质量管理体系-用于法规的要求
术语和定义:质量管理体系 管理职责 资源管理 产品实现 采购 生产和服务提供 监视和测量装置的控制
国际标准化组织ISO:由各国标准化团体[ISO团体]组成的世界性的联合会。制定工作由ISO技术委员会完成,ISO与国际电工委员会IEC在电工技术标准化方面保持密切合作关系。
本标准基于ISO 9001:2008的独立标准。
3.1忠告性通知:医疗器械交付后对其使用、改动、返回组织或销毁作出的补充信息或建议采取措施。
3.2授权代表:委托的法律义务的自然人或法人。
3.3临床评价:评定和分析与医疗器械有关的临床数据,当按照制造商的预期使用时,以验证医 疗器械的安全和性能。
3.4抱怨:任何以书面、电讯、口头的形式宣称,已经从组织控制中放行的医疗器械在其特 性、质量、耐用性、可靠性、使用性、可用性及性能存在不足的行为或影响医疗 器械性能的服务。
3.5经销商
《医疗器械 质量管理体系 用于法规的要求》标准代号是YYT 0287-2008idt ISO13485-2008
对标书的评审指的是组织对
ISO13485医疗器械内审试题_答案_文档下载 (wendoc.com)
内审员的类别:主要有 ISO9001质量管理体系、ISO14001环境管理体系、OHSAS18001职业健康安全管理体系、ISO22000食品安全管理体系、二合一、三合一、四合一、五合一、六合一、ISO/TS16949汽车质量管理、ISO13485(YY/T0287)医疗器械质量管理、内部校验员(量规与仪器校正)、ISO/IEC17025检测和校准实验室认可、ISO27001信息安全管理体系、ISO50001(GB/T23331:2009)能源管理体系、ISO15189医学实验室认可、ROHS-QC080000有害物质管理体系、ISO31000风险管理、GB/T50430工程建设施工企业质量管理体系、IRIS国际铁路行业标准、ISO22716化妆品良好生产规范标准、ISO28000供应链安全管理体系、ISO14064温室气体排放、ISO10006项目管理体系、ISO26000社会责任国际标准、TL9000电信行业质量管理体系、ISO10012测量管理体系、ISO10015培训管理体系、ISO10002投诉处理与顾客满意、ISO/IEC17020检查机构认可准则、ISO/IEC20000IT服务管理体系、CCC中国电子产品强制认证、有机产品内部检查员、GMP药品生产质量管理规范、CE欧盟安全标志产品强制认证、知识产权等等。
ISO 19011- 2018个人中译本(完整).pdf 文档全文免费预览 (book118.com)
ISO13485-2016中文版.pdf-全文可读 (book118.com)
QMS系统
QMS[Quality Management System]:质量管理体系,包括管理职责,资源管理,价值创造过程,测量/分析/改进等四个方面。
绝大部分PCB企业面临的质量管理困境:
生产特点:多品种小批量;工序多,过程复杂;
产品特点:品质要求高;精细化程度高;
质量管理:手工采集信息;人工传递信息、人工统计分析;纸质资料存档;信息流和业务流分离。
制程管理战略涵盖:来料检验分析、LQC生产检验缺陷采集、PQC功能测试缺陷采集、OQC出货检验缺陷采集、抽检加严、DPPM缺陷分析、SPC分析、制程品质能力评估等。(参考产品管理(PMS)_软件产品_MES执行系统_生产线看板系统-品质管理-物流管理-条码追溯管理系统-智慧工厂解决方案-东莞邦 (hhytm.com))
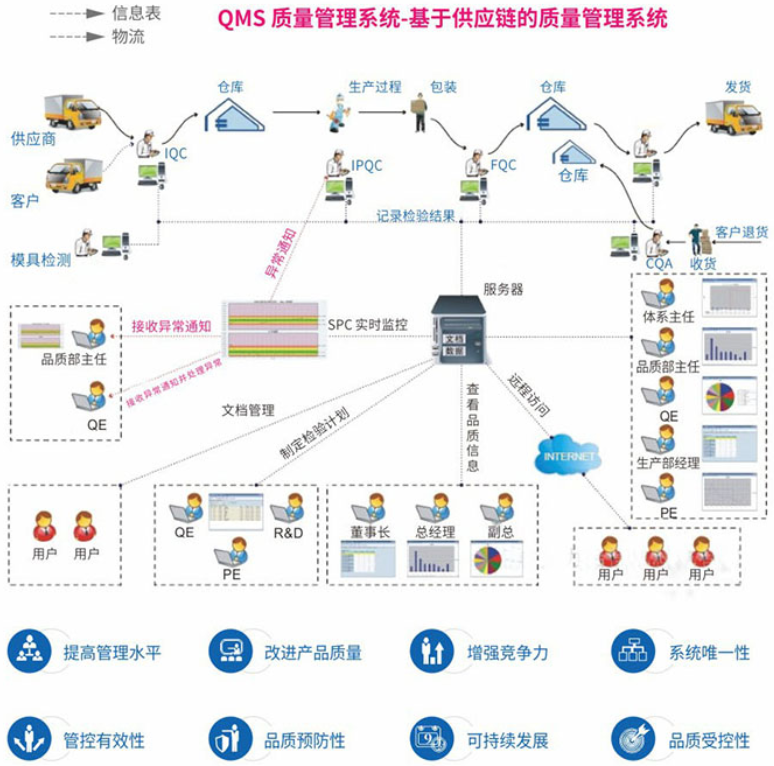
eg:捷讯QMS"物联网+智能终端推送预警"

捷讯QMS品质管理系统的核心功能与收益:
1、品质追溯针对客户投诉一件追踪溯源
2、实时SPC分析预警降低报废率
![]()
3、自动化统计品质报表减员增效
![]()
4、生产品质可视化方便实时
1、为何内审:
合规性:FDA ISO法规对组织的要求;
改进:减少缺陷,不合格,提高生产力;
2、审核专案:高层领导人员发起和支持,根据公司规模,性质,依据标准,范围目标,频率,被审核的性质,功能,风险类型等;
审核专案定义了审核专案经理的角色和职责;确定了审核计划的范围;识别和评估专案风险和机会;建立流程管理程序;确定所需的资源;监督审核专案并改进体系。
审核程度:
更频繁审核产品特性:引入或与产品相关危险;与健康安全相关危险;与环境影响相关危害。
审核专案相关风险:规划不周;资源;审核团队;沟通;可取样证据的可用性。
审核员的检查点:QSR,ISO3485,所有必要程序的预期与实施;其他系统文档有效流程管控;证据支持质量体系的建立和实施;流程控制的证据证明组织有效记录系统。
执行审核--审核流程:启动,准备,开幕会议,执行审核,审核团队会议,审核发现,闭幕会议,审核报告,后续验证、纠正措施。
审核计划时间表的考量/注意事项:
活动的状态[过多故障,重大缺陷,现场安装或过度服务];
与审核计划相关的风险;
活动/产品的重要型