第3章 化学反应速率
3.1 化学反应速率
速率为正值
因此要注意可能会加负号。
核心:(LARGE v= frac{Delta c}{Delta t})
注意:固体与纯液体不考虑(Delta c)
对于反应
我们有
- 瞬时反应速率:
- 切线
- 起始反应速率最重要
3.2 速率与反应物浓度之关系
(Large cuparrow) 则 (Large v uparrow)
3.2.1 速率方程与级数
对于任意反应:
一般有(v=k extrm{[c(A)]}^m extrm{[c(B)]}^n),此时(m+n)代表该反应的级数。“该反应对于( extrm{A})是(m)级的,对( extrm{B})是(n)级的。”
但有的反应速率方程很复杂,如
这种就不谈级数啦
3.2.2 速率常数
还是这个反应
我们有
但请注意,这里的(Delta c)都是反应物的变化,等式左边的变化。也就是说,这里的(v)都是正反应速率。我们这里不讨论逆反应速率(本质一样)。
由各个物质反应速率除以化学计量数相等,可以得到:
既:(Large extrm{速率常数之比等于化学计量数之比})
这里有个小技巧,(n)级反应的速率常数单位为 ( extrm{dm}^{3(n-1)} cdot extrm{mol}^{-(n-1)} cdot extrm{s}^{-1}) 因此,(large extrm{mol的指数绝对值+1等于}) (large extrm{级数n})。
3.3 反应速率理论简介
3.3.1 有效碰撞理论
- 分子有效碰撞即立刻反应完全
- 有效碰撞需要合适的分子取向和足够的能量(活化能)
如果记活化能为(E_a),能量够的碰撞次数占总碰撞次数的分数为(f)((large f=e^{-frac{E_a}{RT}}) ),总碰撞次数为(Z),取向因子为(P);
则实际有效碰撞次数
3.3.2 过渡态理论
- 旧键部分断裂,新键部分形成
- 分子动能暂时转变为活化配位化合物的势能
- 活化配位化合物很不稳定,会向生成物和反应物转化。
故
3.4 反应机理
3.4.1 基元反应
- 没有中间产物的反应
- 反应分子数的值=级数的值
注:1. 反应分子数代表微观,级数代表宏观。
2. 非基元反应不谈反应分子数
基元反应也是反应,故反应速率方程类似。但基元反应一定满足(v=k[c( extrm{A})]^a[c( extrm{B})]^b)。即指数一定是化学计量数,这与一般的速率方程不同。这个公式也叫质量作用定律。
3.4.2 反应机理的几个假设
速控步假设
反应的速度由最慢的基元反应决定(决速步骤)
稳态近似法
除了决速步骤,认为其他基元反应产生的中间产物达到稳定状态后浓度不变,即 (v_{生成}=v_{消耗})
平衡假设法
即假设快反应的平衡反应很快达到平衡,正逆反应速率相等
例:

例2:
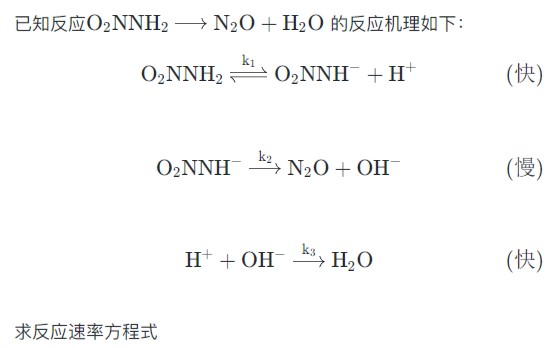
3.5 反应物浓度与时间的关系
3.5.1 零级反应
反应速率与反应物浓度无关,故 (c=c_0-kt)
3.5.2 一级、二级、三级反应
利用高等数学的知识可得
或用常用对数表示
半衰期:
对于一级反应,(t_{1/2}) 和 (k) 知一求一
- 只有一种反应物的二级反应
- 只有一种反应物的三级反应