Alzheimer disease的病理特征:
AD is pathologically defined by severe neuronal loss, aggregation of amyloid β (Aβ) in extracellular senile plaques, and formation of intraneuronal neurofibrillary tangles consisting of hyperphosphorylated tau protein.
early-onset AD,at age older than 65 years (late-onset AD)
【1】The genetic landscape of Alzheimer disease: clinical implications and perspectives,Caroline Van Cauwenberghe, Christine Van Broeckhoven, Kristel Sleegers,Genet Med. 2016 May
AD 的病因:时至今日,AD的病因和病程仍在探索中。目前唯一能确定的病因是基因突变,包含三种基因:β-淀粉样蛋白前体 ( APP )、 衰老前素-1 ( PS1 )和衰老前素-2 ( PS2 ) 的突变。但AD患者中仅有1%是由于这一类基因突变而发病,其余仍然还是谜团。
由于AD并非一个由单因素引起的疾病,在病因难以明确的情况下,医学上仍然没有可靠的方法预防AD,只能通过一些方法降低老年人的患病风险,对早期患者进行早诊断、早干预。
来自:https://xw.qq.com/partner/hwbrowser/20190108A0PR3B/20190108A0PR3B00?ADTAG=hwb&pgv_ref=hwb&appid=hwbrowser&ctype=news
AD的基因组特征:AD的高风险基因有4个,分别是APP,PSE1,PSE2和APOE。
对家族性的AD进行研究,发现了3个常染色体显性遗传的基因:APP, PSEN1, and PSEN2。
通过对大样本量的晚发性AD(late-onset AD,LOAD)和家族形AD研究,发现一个易感基因APOE(载脂蛋白E)的E4等位基因。APOE E4是目前唯一发现的散发性AD的遗传风险因子。
APP的详细内容??
AD的诊断:与AD相关的病理特征有2个:淀粉样斑块(amyloid plaques)和神经纤维缠结(neurofibrillary tangles,NFT)。其中,淀粉样斑块的主要成分是Aβ,位于神经细胞之间;NFT的主要成分是tau蛋白,位于细胞内部。个人认为神经纤维缠结更严重。
AD的确诊需要临床评估和尸检的确认。尸检需确认AD的2个组织病理特征:神经纤维缠结和淀粉样斑块(neurofibrillary tangles and amyloid plaques)。
AD的蛋白:
与AD相关的蛋白有两种,分别是淀粉样蛋白Aβ和tau蛋白。Aβ是淀粉样斑块的主要成分,tau蛋白形成了神经纤维缠结。而APOE基因,其E4基因型是AD的高风险基因。
1. 淀粉样斑块的主要成分是淀粉样蛋白Aβ(amyloid-β, Aβ)。Aβ由分泌酶分解后的淀粉样前体蛋白(APP)衍生而来。Amyloid-β is derived from the amyloid precursor protein (APP) after cleavage by secretases.
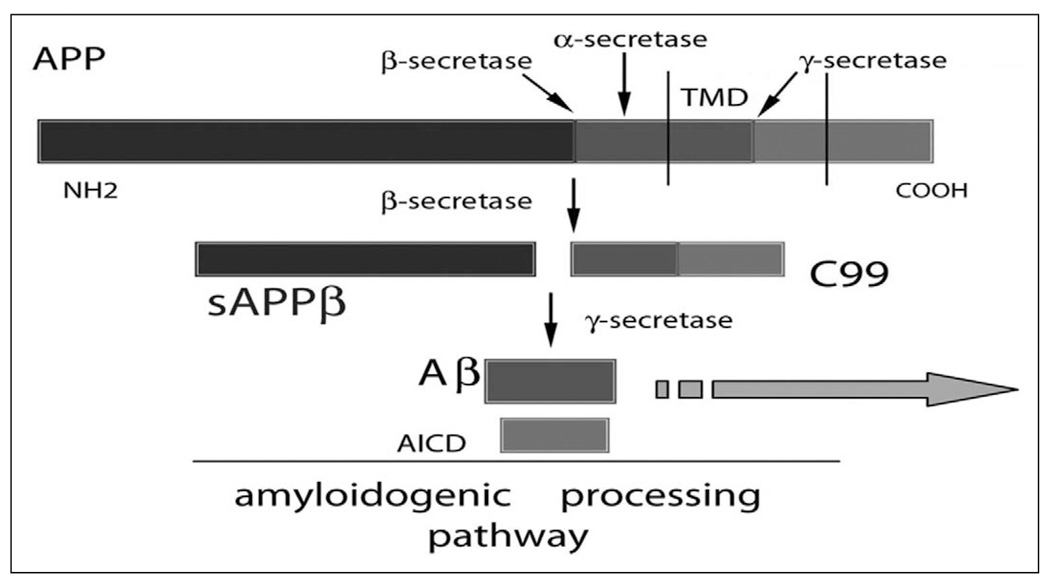
2. 携带神经纤维缠结(neurofibrillary tangles,NFT)的神经元是AD大脑中另一个常见的发现,这些缠结的神经纤维含有高磷酸化tau(微管相关蛋白。tau正常结合在神经元内的微管中并稳定微管。微管是神经元骨架的主要结构;负责guide营养物质到树突和轴突;微管有a、β微管蛋白及微管相关蛋白组成。异常的tau蛋白从微管上脱落,过度磷酸化后相互聚集,最后形成缠结。)比淀粉样斑块更能反映疾病的严重程度。缠结是由过度磷酸化的tau形成的,它以一种不可溶解的形式聚集。但是,神经纤维缠结在其他疾病中也存在。而且,NFT与认知和记忆的下降没有关系,同时,编码tau的MAPT的基因突变与AD无关。
3. APOE基因与家族性和散发性AD都有关系,APOE ε4的基因型与AD的高风险有关。APOE蛋白(apolipoprotein,ApoE,载脂蛋白E)在星形胶质细胞中表达,压力或受损时,神经元也表达ApoE,促进神经元修复。
参考文献:【1】Genetics of Alzheimer Disease,2010,J Geriatr Psychiatry Neurol
AD诊断
PET技术,示踪剂,活体检测。测量脑区的糖代谢。
在区别AD与其它痴呆时,特异性较低;但在鉴别AD时,有90%的灵敏度。
FDG-PET研究显示内侧颞叶代谢活动的降低是识别轻度认知损伤最特异最灵敏的手段。
Parkinson disease的病理特征:
tau蛋白:
α-突触核蛋白α-synuclein:
α-突触核蛋白α-synuclein:α-突触核蛋白参与神经元之间的交流。目前通常认为,α-突触核蛋白错误折叠后产生毒性,导致帕金森病。α-突触核蛋白聚集体从病人的组织扩散到移植组织。
α-突触核蛋白能否扩散?
答:试管实验已经证实,单分子 α-突触核蛋白的错误折叠形式可诱导其他单分子进行同样的错误折叠,这些分子簇集成更大的寡聚体,最终形成细丝状结构,称为纤丝(fibrils) 。其中的一些聚集体从寡聚体中脱离,形成种子,招募更多的单分子,从而加速这个过程。扩散理论需要解决的一个核心障碍是,通常认为 α-突触核蛋白只存在于细胞内。这与 PrP 以及 β-淀粉样蛋白(阿尔兹海默症中的罪魁祸首)相反,它们都存在于细胞外。细胞培养研究已经提示,神经元可以吸收和释放 α-突触核蛋白,尽管机制并不清楚。
α-突触核蛋白可以错误折叠和聚集,而且也可能进出神经元。但是它可以在大脑中扩散吗?2014 年,巴塞罗那大学的一个团队将人脑来源的路易小体注射到四只猕猴的黑质和纹状体 [9]。14 个月以后,研究者观察到了神经元逐渐退化,首先是自黑质神经元延伸到纹状体的长轴突,随后是黑质神经元自身。尽管这是一个小样本研究,而且他们没有报道任何功能性变化,第一个证明帕金森病患者大脑来源的 α-突触核蛋白可以在我们进化上的近亲中触发帕金森病样病理的证据。
朊病毒蛋白(PrP)有一种正常的折叠形式,但一旦错误折叠,可诱导其他正常折叠的 PrP 错误折叠——也即实现自我扩散,最终导致疾病。伴随着错误折叠的 PrP 的扩散,它们会损害并最终杀死细胞。
AD诊断标准:
轻度认知受损(mild cognitive impairment,MCI)到全面的阿尔兹海默症(full-blown Alzheimer’s)的阶段